Джерелом близько 50 % електрики в Україні є поділ ядер Урану на атомних станціях. Майбутня термоядерна енергетика — це забезпечення людства електрикою після вичерпання вуглеводневих запасів палива. Водночас зі словом «ядерний» пов'язані величезні трагедії в історії людства — згадайте атомні бомби, скинуті на Японію в 1945 р., Чорнобильську катастрофу 1986 р., аварію 2011 р. на АЕС «Фукусіма» в Японії. У 9-му класі ви почали знайомство з явищами 8 мікросвіті. У цьому розділі продовжите вивчення атомної та ядерної фізики.
Як з'явилася ядерна модель атома
Експерименти, проведені різними вченими протягом XIX ст. (зокрема, англійцями Джоном Дальтоном (1766-1844), Майклом Фарадеєм (1791-1867), французом Антуаном Анрі Беккерелем (1852— 1908) та ін.), надали незаперечні докази того, що атом має складну структуру. Фізикам стало відомо, що до складу атома входять електрони, які мають негативний заряд, а атом загалом є нейтральним. Але якою є структура атома?
Одну з перших моделей будови атома запропонував у 1903 р. англійський фізик Джозеф Джон. Томсон (1856-1940). Він припустив, що атом має форму кулі; позитивний заряд атома розподілений рівномірно по всьому об’єму цієї кулі, а негативно заряджені електрони вкраплені в її середину. Подальший прогрес у дослідженнях внутрішньої структури атома пов’язаний з ім’ям англійського фізика Ерне-ста Резерфорда (1871-1937). Досліди, проведені під його керівництвом у 1908-1911 рр., було докладно описано в курсі фізики 9-го класу. Нагадаємо, що в ході цих дослідів вивчалося розсіювання а-частинок ядрами Ауруму. Схему одного з таких дослідів наведено на рис. 50.1.
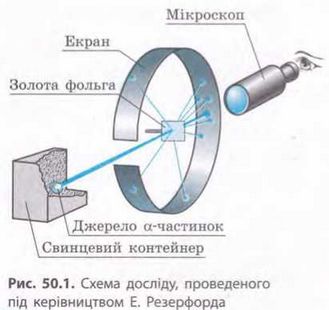
Якби будова атома відповідала моделі Томсона, то α-частинки практично не розсіювалися б, оскільки їх енергія є величезною. Однак під час дослідів Резерфорда деякі α-частинки відхилялися на великі кути. Учений припустив, що розсіювання а-частинок пояснюється тим, що позитивний заряд і маса в атомі не розподілені рівномірно по всьому об’єму атома, а зосереджені в його невеликій центральній частині — ділянці, яку назвали ядро атома. За аналогією з будовою Сонячної системи, нова модель атома була названа планетарною, або ядерною, моделлю.
Постулати Бора
Планетарна модель атома, блискуче пояснивши результати експериментів із розсіювання α-частинок, разом з тим суперечила класичним законам електродинаміки. Рух планетарною орбітою, як відомо, є рухом із прискоренням (доцентровим), а відповідно до теорії Дж. Максвелла прискорений рух зарядженої частинки супроводжується випромінюванням. Отже, електрон в атомі мав би випромінювати електромагнітні хвилі та відповідно — втрачати енергію. А наслідками цього були б зменшення швидкості руху електрона та його падіння на атомне ядро.
Модифікацію планетарної моделі здійснив у 1913 р. данський фізик Нільс Бор (1885-1962). Він припустив існування в атомі особливих станів електронів. Ці стани визначаються на підставі двох гіпотез, які дістали назву постулати Бора.
Перший постулат Бора:
Існують особливі стани атома, в яких він не випромінює енергію. Такі стани атома називають стаціонарними станами.
Стаціонарний стан атома означає, що його електрони локалізовані в просторі (у Н. Бора йшлося про радіус орбіти електрона, зараз ми говоримо про орбіталі електронів) та мають певну енергію. Щоб визначити характеристики стаціонарних станів атомів, слід звернутися до курсу механіки. Коли розглядають умови рівноваги тіл, використовують поняття моменту сили. Більш загальне визначення цього терміна — момент імпульсу. У найпростішому випадку, коли векторні величини перпендикулярні одна до одної, момент імпульсу L тіла визначається як L=mvr, де т — маса тіла; v — модуль швидкості його руху; г — відстань до точки обертання тіла. Отже, згідно з першим постулатом Бора орбітальний момент імпульсу електрона може набувати тільки дискретних значень:
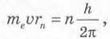
де те — маса електрона; υ — швидкість руху електрона; г„ — радіус стаціонарної орбіти атома; п = 1, 2, 3, 4, ... (цілі числа);
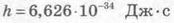
стала Планка.
У ядерній фізиці часто використовують величину

Другий постулат Бора:
Будь-яке випромінювання атома пов'язане з його переходом з одного стаціонарного енергетичного стану в інший.
Для переходу атома з одного стаціонарного стану в інший зі значеннями енергій £, і Е2 справджується рівність:

Для наочної демонстрації енергетичного стану атома застосовують спеціальні схеми. Кожний стаціонарний (дозволений) стан атома
позначають лінією, яку називають енергетичним рівнем. Найнижчий рівень називають енергетичним рівнем основного стану. Вище від нього розташовані інші дозволені рівні. Переходи атома з одного стану в інший зображують вертикальними стрілками (рис. 50.2).
Є очевидним, що насправді стаціонарним є тільки нижній рівень, на якому кожен атом може перебувати нескінченно довго. Щойно електрон буде «закинуто» на вищий рівень, він негайно й довільно перейде в основний стан із випромінюванням фотона. Тому всі інші стаціонарні стани атома з енергіями Е2, Е3, ..., Еп називають збудженими станами.

Рис. 50.2. Схема енергетичних рівнів в атомі та схема переходів електронів з одного енергетичного рівня на інший (переходи показано стрілками). Зверніть увагу на те, що в разі переходу на нижчий рівень електрон випромінює електромагнітні хвилі, а у випадку зворотного переходу поглинає їх. Електромагнітне випромінювання позначено хвилястою лінією
Зверніть увагу: коли йдеться про збуджений стан, матимемо на увазі як збуджений атом (в якому електрон перейшов з основного на вищий рівень), так і електрон, що міститься на одному з верхніх енергетичних рівнів.
Спираючись на свої постулати, Бор обчислив довжини хвиль світла, що випускається або поглинається атомом Гідрогену під час переходу електрона з однієї орбіти на іншу. Задовго до теорії Бора ці величини вже було виміряно швейцарським фізиком Йоганном Яко-бом Бальмером (1825-1898). На честь дослідника їх було названо серії Бальмера. Обчислення Бора дали дивовижно точний збіг теоретичних даних з експериментальними результатами (на рівні 0,001 %). Учимося розв'язувати задачі
Задача. Визначте радіус першої орбіти атома Гідрогену (так званий радіус Бора). Маса електрона 9,11 10 31 кг; заряд електрона 1,60 10 19 Кл; стала Планка 6,63 10 34 Дж с ; електрична стала 8,85 Ю'12 Ф/м.
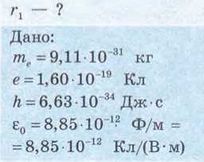
Аналіз фізичної проблеми, пошук матема тичної моделі. Щоб розв’язати задачу, скористаємося формулою для орбітальних моментів імпульсу:
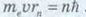
Оскільки слід знайти значення першого радіуса, то п = 1. Невідоме у формулі значення швидкості електрона на орбіті знайдемо з рівнянь механіки (рух тіла по колу). Розв’язання. Доцентрове прискорення а визначається кулонівською силою притягання до ядра Гідрогену:
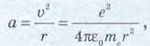

електрична стала. У формулі було враховано, що заряд ядра Гідрогену (протона) дорівнює заряду електрона.
Орбітальний момент імпульсу електрона на першій орбіті:
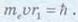
Далі одержимо вираз для
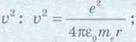
підставимо значення υ
у першу формулу та знайдемо рівняння для
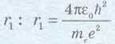
Врахову
ючи, що

Визначимо значення шуканої величини:
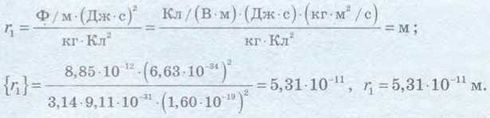
Відповідь: радіус першої орбіти атома Гідрогену
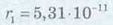
Принцип Гіаулі
Ми описали стаціонарні стани одного електрона в атомі Гідрогену. Для атомів із більшою кількістю електронів теж можна знайти енергетичні рівні, якщо скористатися методами сучасної квантової механіки. На перший погляд здається, що відповідно до принципу мінімуму енергії всі електрони перебуватимуть у стані з найменшою енергією, тобто їхні спектри випромінювання будуть однаковими. Але це повністю суперечить експериментальним даним. Отже, постулатів Бора виявилось недостатньо для пояснення будови атомів. Для усунення суперечності на допомогу приходить сформульований у 1925 р. австрійським фізиком Вольфґанґом Ернестом Паулі (1900-1958) так званий принцип Паулі:
У будь-якій квантовій системі два й більше електронів не можуть перебувати одночасно в тому самому квантовому стані.
Іншими словами, виявилося, що електрони — «яскраві індивідуалісти», яким «заборонено жити разом». Тому принцип Паулі іноді називають принципом заборони Паулі.'
Фізичні основи побудови Періодичної системи хімічних
елементів
Усі ви, без сумніву, пам’ятаєте ім’я видатного російського вченого Дмитра Івановича Менделєєва (1834-1907) та створену ним Періодичну систему хімічних елементів. Але, мабуть, не всі знають, що Д. І. Менделєєв знайшов дивовижне застосування відкритому ним закону періодичності хімічних властивостей атомів: він зміг передбачити існування шести елементів, які на той час ще не були відкриті й мали зайняти незаповнені клітинки в його таблиці. Згодом усі ці елементи були відкриті (або отримані штучно) і з’ясувалося, що вони мають властивості, передбачені Д. І. Менделєєвим. Сучасна квантова
механіка надала повне теоретичне обґрунтування періодичного закону, відкритого Д. І. Менделєєвим.
Можливість такого передбачення, без сумніву, означає, що елементи, об’єднані в Періодичній системі хімічних елементів Д. І. Менделєєва в„ групи, мають схожі властивості. Зараз ви «озброєні» принципом Паулі та принципом мінімуму енергії системи. Тож спробуємо передбачити деякі спільні властивості елементів на основі одержаних знань. Згадавши з курсу хімії правила заповнення електронних оболонок, порівняємо, наприклад, властивості елементів із повністю заповненими електронними оболонками. Першими з таких елементів будуть № 2 (повністю заповнена перша оболонка) і № 10 (повністю заповнені дві оболонки). Імовірно, що електронна структура цих атомів дуже стійка і хімічна взаємодія цих елементів з іншими має бути дуже слабкою.
А тепер звернемося до Періодичної системи. Назва елемента № 2 — Гелій, елемента № 10 — Неон. Із курсу хімії пригадуємо, що обидва елементи є газами, атоми яких справді хімічно інертні; у системі вони об’єднані в групу під назвою «Інертні гази». Спробуйте тепер самі передбачити властивості інших елементів.
Підбиваємо підсумки
Дослідження, проведені фізиками в XIX ст., довели атомарну структуру речовини й підтвердили, що атом має складну будову. Експерименти, виконані під керівництвом Е. Резерфорда, дозволили створити планетарну модель атома.
Розвитком планетарної моделі атома стали постулати Бора, згідно з якими електрони в атомі можуть перебувати тільки на певних («дозволених») орбітах. Рухаючись такою орбітою, електрон не випромінює електромагнітних хвиль. Випромінювання / поглинання електромагнітних хвиль (чітко визначеної частоти) відбувається тільки під час переходів електрона з однієї дозволеної орбіти на іншу.
Додатково до постулатів Бора був сформульований принцип Паулі, що «забороняє» перебування двох електронів на орбітах з однаковими квантовими числами. Правила заповнення багатоелектронних оболонок в атомах визначаються принципом Паулі й вимогою мінімізації енергії системи. Схожість хімічних властивостей елементів зумовлена подібністю будови їхніх електронних оболонок. Квантова механіка дала теоретичне обґрунтування закону періодичності хімічних властивостей атомів.
Контрольні запитання
1. Які вчені зробили значний внесок у створення атомістичної теорії? 2. Опишіть дослід, проведений під керівництвом Е. Резерфорда, із розсіювання а-частинок атомами Ауруму. 3. У чому полягає розбіжність між моделями атомів, запропонованими Дж. Дж. Томсоном і Е. Резерфордом? 4. Яким експериментальним даним суперечить планетарна модель атома Резерфорда й чому? 5. У чому сутність постулатів Бора? ж б. Сформулюйте принцип Паулі. Наведіть приклад його застосування. ★ 7. Наведіть приклади подібності властивостей елементів, яка зумовлена подібністю будови електронних оболонок атомів цих елементів.
Вправа № 37
1. Обчисліть загальну енергію електрона, який перебуває на третій орбіті атома Гідрогену.
2. Визначте енергію, яку випромінює електрон під час переходу в атомі Гідрогену з п'ятої орбіти на першу.
3. Унаслідок опромінювання атомів Меркурію електронами енергія атомів збільшується на 4,9 еВ. Якою буде довжина хвилі випромінювання під час переходу атомів Меркурію в незбуджений стан?
Це матеріал з підручника Фізика 11 клас Бар'яхтар