Матеріал параграфа допоможе вам:
зрозуміти, чому розчини і розплави деяких речовин проводять електричний струм; розрізняти електроліти і неелектроліти; дізнатися про те, як можна виявити йони в розчині.
Загальновідомо, що метали проводять електричний струм. Така властивість зумовлена наявністю в металах електронів, які не утри-
муються атомами і вільно переміщуються в речовині. Якщо з’єднати металеву дротину або пластину з батарейкою (акумулятором), то ці електрони починають рухатися до позитивно зарядженого полюса батарейки, й виникає електричний струм.
Солі, основи, основні та амфотерні оксиди містять заряджені частинки іншого типу — йони. З’ясуємо за допомогою фізичного експерименту, чи здатні речовини йонної будови проводити електричний струм. Зберемо прилад, який складається зі склянки, двох електродів1, лампочки і батарейки (мал. 19).

Будемо занурювати електроди у тверді речовини, їхні розплави, водні розчини. Виявимо, що лампочка горітиме лише тоді, коли електроди перебувають у рідині — розплаві або розчині йонної речовини (мал. 20).

Електродом може слугувати стержень або пластина з електропровідного матеріалу — металу або графіту.
Пояснимо результати дослідів.
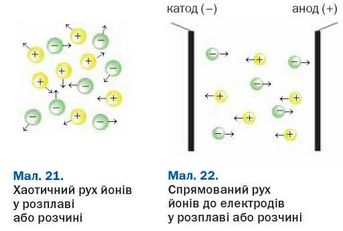
У твердій речовині йони сполучені один з одним, тому речовина не проводить електричний струм. У рідині (розплаві, розчині) йони рухаються хаотично (мал. 21). Якщо в неї занурити електроди, з’єднані із джерелом постійного струму, рух йонів стає спрямованим. Позитивно заряджені йони (катіони) прямуватимуть до негативно зарядженого електрода (катода), а негативно заряджені (аніони) — до позитивно зарядженого електрода (анода) (мал. 22).
Електропровідними є не лише розплави і водні розчини йонних речовин, а й водні розчини деяких молекулярних речовин — кислот. Причина полягає в тому, що під час розчинення кислоти у воді частина її молекул руйнується з утворенням йонів. Цей процес розглядатимемо в наступному параграфі.
Сполуки, водні розчини і розплави яких проводять електричний струм, називають електролітами1.
Загальна назва речовин, розчини і розплави яких не проводять струму, — неелектроліти.

Майкл Фарадей (1791—1867)
Видатний англійський фізик і хімік, член Лондонського королівського товариства (Англійської академії наук), почесний член Петербурзької академії наук. Відкрив закони, що встановлюють залежність між кількістю електрики і масами речовин, які розкладаються або утворюються за дії електричного струму (1833—1834). Удосконалив спосіб скраплення газів і добув у рідкому стані хлор, сірководень, амоніак, нітроген(IV) оксид. Одним із перших розпочав вивчати реакції, які відбуваються за наявності каталізаторів. Здійснив фундаментальні дослідження з електрики, магнетизму, зробив чимало відкриттів у фізиці. Не мав вищої освіти.
Електроліти
(у водному розчині): солі, луги, кислоти
До них належать багато молекулярних речовин, а також речовини атомної будови.
Значний внесок у дослідження електропровідності водних розчинів зробив на початку ХІХ ст. англійський учений Майкл Фарадей.
Електроліти
(у розплавленому стані): солі, луги, йонні оксиди
Рух йонів у розчині можна виявити за допомогою простого досліду. На скляну або полімерну пластину кладуть аркуш фільтрувального паперу і змочують його безбарвним розчином електроліту (наприклад, натрій хлориду). Потім у центр аркуша наносять кілька крапель розчину солі, що містить забарвлені катіони (купрум(ІІ) сульфату CuSO4, нікель(ІІ) сульфату NiSO4, ферум(ІІІ) хлориду FeCl3) або аніони (калій перманганату KMnO4, калій дихромату K2Cr2O7). На папір по обидва боки від центра кладуть два електроди і з’єднують їх дротинками з батарейкою (мал. 23). Кольорова пляма починає зміщуватися до одного з електродів.
До якого електрода — позитивно чи негативно зарядженого — рухатимуться катіони
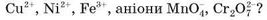
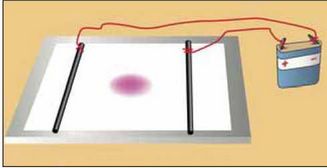
Мал. 23.
Дослід із виявлення руху забарвлених йонів у розчині до електродів
ВИСНОВКИ
Сполуки, водні розчини і розплави яких проводять електричний струм, називають електролітами. До електролітів належать усі йонні речовини — луги, солі, основні й амфотерні оксиди, а також частина молекулярних речовин — кислоти (вони проводять струм лише у водному розчині). Інші речовини є неелектролітами.
39. Які речовини проводять електричний струм у твердому стані? Назвіть частинки, що зумовлюють електропровідність цих речовин.
40. Які речовини називають електролітами? Наведіть кілька прикладів.
41. Поясніть, чому водний розчин натрій хлориду проводить електричний струм.
42. Водопровідна вода, на відміну від дистильованої, проводить електричний струм. Як це пояснити?
43. Електропровідність якої води вища — морської чи річкової? Чому?
44. Назвіть класи сполук, що є електролітами:
а) лише у водних розчинах;
б) у водних розчинах і в рідкому (розплавленому) стані.
45. У переліку речовин укажіть ті, що проводять електричний струм у рідкому (розплавленому) стані: барій оксид, сірка, хлороводень, магній хлорид, калій гідроксид, сульфур^) оксид. Поясніть свій вибір.
46. Обчисліть сумарну кількість йонів:
а) у 20,0 г літій оксиду; в) у 20,4 г алюміній оксиду;
б) в 11,7 г натрій хлориду; г) у 41,0 г кальцій нітрату.
Це матеріал з підручника Хімія 9 клас Попель, Крикля